重组胶原蛋白含量之争:海能凯氏定氮与高效液相色谱双法解疑!
2025/05/30 14:02 I 阅读:364
最近,知名美妆护肤品牌卷入成分争议风波。有博主质疑称该品牌一款重组胶原蛋白精华的产品涉嫌造假,重组胶原蛋白真实添加量为0.0177%,且未检测出胶原蛋白的核心氨基酸成分——甘氨酸。该公司声明,产品成分标注均按法定标准执行并通过药监部门审核备案,不存在任何成分造假或隐瞒行为。双方争论的核心还在于检测方法的不同。(点击查看详情~)
重组胶原蛋白作为生物医药与护肤领域的高效活性原料,其真蛋白含量直接决定产品的功效与质量,且氨基酸作为基本组成单元构成重组胶原蛋白的链状结构,其特定序列与修饰(如羟脯氨酸)直接决定其三螺旋稳定性及生物学功能。本文使用“凯氏定氮法”检测重组胶原蛋白中的总氮、非蛋白氮及真蛋白含量,并使用“高效液相色谱法”检测重组胶原蛋白中的氨基酸含量,为广大生产企业、第三方检测机构及监管部门提供支持。
〣凯氏定氮法〣
根据《YY/T 1947-2025 重组胶原蛋白敷料》中要求,重组胶原蛋白含量可按照《中华人民共和国药典》(2020年版 四部)通则0731蛋白质含量测定法的“凯氏定氮法”进行测定,采用钨酸钠沉降法沉淀样品中的蛋白质,通过差减法减去样品中非蛋白氮含量,从而得到真蛋白含量。
实验方案
1. 仪器
海能K1160全自动凯氏定氮仪、SH420F石墨消解仪、分析天平等。

2. 试剂
甲基红、溴甲酚绿、硼酸、氢氧化钠、无水硫酸钾、五水合硫酸铜、浓硫酸、钨酸钠。
3. 样品
重组胶原蛋白修复液。
4. 实验过程
试剂配制完成后,进行样品称量。
5. 样品称量
① 总氮含量测试:通过减量法准确称取样品5 g左右(精确至0.1 mg),并转移至洁净的消化管中。
② 非蛋白氮含量测试:通过减量法准确称取样品5 g左右(精确至0.1 mg),置于20 mL容量瓶中,加入10 mL的纯水、2 mL的10%钨酸钠溶液和2 mL的0.33 mol/L硫酸溶液,加水定容至刻度。摇匀,静置30分钟后,于3000 rpm下离心5 min以促进样品过滤。随后取上清液进行过滤,弃去初滤液(约5滴),取续滤液,使用10 mL移液管准确量取10 mL滤液于消化管中待测。空白消化管中则需加入8 mL的纯水、1 mL的10%钨酸钠溶液和1 mL的0.33 mo1/L硫酸溶液。
6. 消解
向空白及样品消化管中加入0.2 g硫酸铜、3 g硫酸钾和10 mL浓硫酸后上机消解。消解程序如表1:
表1 SH420F石墨消解仪消解程序设置
阶梯 | 温度梯度/℃ | 保温时间/min |
1 | 220 | 20 |
2 | 420 | 90 |
7. 蒸馏与滴定
待消解程序完成,消化管冷却并无酸雾后,使用凯氏定氮仪进行检测,定氮仪参数设置如表2:
表2 K1160全自动凯氏定氮仪试验参数设置
滴定酸 (H+) mol/L | 0.0207 |
硼酸/mL | 30 |
氢氧化钠/mL | 40 |
稀释水/mL | 40 |
蒸馏时间/min | 5 |
8. 测试结果
样品经消解和上机测试,重组胶原蛋白产品中总氮、非蛋白氮及真蛋白含量如表3至表5所示:
表3 样品中总氮含量表
样品 名称 | 称样量 /g | 空白体积 /mL | 滴定体积 /mL | 氮含量 (mg/g) | 氮含量均值 (mg/g) |
修复液 | 5.0482 | 0.1949 | 5.9730 | 0.3317 | 0.3348 |
5.0104 | 6.0374 | 0.3379 |
表4 样品中非蛋白氮含量表
样品 名称 | 称样量 /g | 空白体积 /mL | 滴定体积 /mL | 非蛋白 氮含量 (mg/g) | 非蛋白氮 含量均值 (mg/g) |
修复液 | 5.1384 | 0.2035 | 1.2107 | 0.1136 | 0.1118 |
5.0509 | 1.1622 | 0.1100 |
表5 样品中真蛋白含量表
样品 名称 | 总氮含量 (mg/g) | 非蛋白氮含量 (mg/g) | 真蛋白含量 (mg/g) |
修复液 | 0.3348 | 0.1118 | 1.1306 |
注:表中真蛋白含量=(样品总氮含量-非蛋白氮含量)×蛋白转换系数(5.07)。
9. 结论
经测试,重组胶原蛋白产品中的总氮、非蛋白氮和真蛋白含量分别为0.3348 mg/g、0.1118 mg/g和1.1306 mg/g。实验结果表明,凯氏定氮仪可用于检测重组胶原蛋白产品中的真蛋白含量。
〣高效液相色谱法〣
高效液相色谱法检测氨基酸时,因氨基酸自身无紫外吸收基团,需借助异硫氰酸苯酯(PITC)、邻苯二甲醛(OPA)、丹磺酰氯(DNSCl)、2,4-二硝基氟苯(DNFB)等柱前衍生试剂引入生色基团,使衍生物具备紫外吸收特性以便被检测。异硫氰苯酯(PITC)作为氨基酸分析中的经典柱前衍生试剂,通过与氨基酸的α-氨基特异性反应生成稳定的苯基硫代氨基甲酰(PTC)衍生物,该衍生物具有强紫外吸收特性(λmax=254nm),可显著提升检测灵敏度至皮摩尔级,同时其反应条件温和、产物稳定性高且能兼容多数氨基酸(包括含羟基或含硫氨基酸),使其在高效液相色谱分析中成为兼顾灵敏度、选择性与操作便捷性的理想选择。本实验采用PITC柱前衍生-高效液相色谱法检测重组胶原蛋白中的16种氨基酸。
实验方案
1. 仪器配置
悟空K2025高效液相色谱仪:K2025 P2二元高压输液泵、K2025 AS自动进样器、K2025 CO柱温箱、K2025 UVD紫外-可见光检测器、Wookinglab色谱工作站。

色谱条件:
色谱柱:JinGuBang AAA ,4.6×250 mm,5 µm;
流动相:流动相A为0.05 mol/L乙酸钠水溶液,流动相B为甲醇-乙腈-水=1:3:1,梯度洗脱如下表:
时间 (min) | 流速 (mL/min) | 流动相A (%) | 流动相B (%) |
0.0 | 1.0 | 95 | 5 |
39.0 | 1.0 | 52 | 48 |
40.0 | 1.0 | 0 | 100 |
45.0 | 1.0 | 0 | 100 |
46.0 | 1.0 | 95 | 5 |
60.0 | 1.0 | 95 | 5 |
进样量:20 μL;
洗针液:90%甲醇水溶液;
柱温:40℃;
检测器及检测波长:检测器为紫外-可见光检测器,检测波长为254 nm。
2. 实验结果
线性范围结果
按照色谱条件进行采集,16种氨基酸混合标准溶液的色谱图如图1所示,积分结果如表1所示。
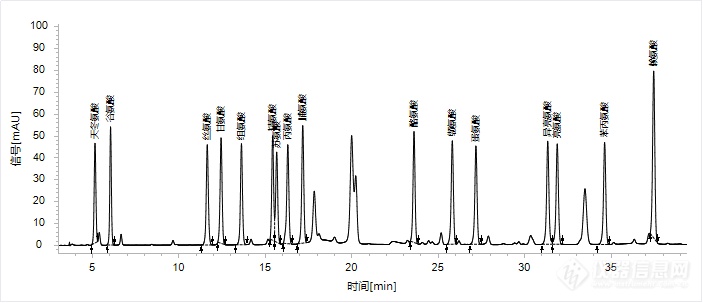
图1 16种氨基酸混合标准溶液的色谱图
表1 16种氨基酸混合标准溶液色谱图积分结果
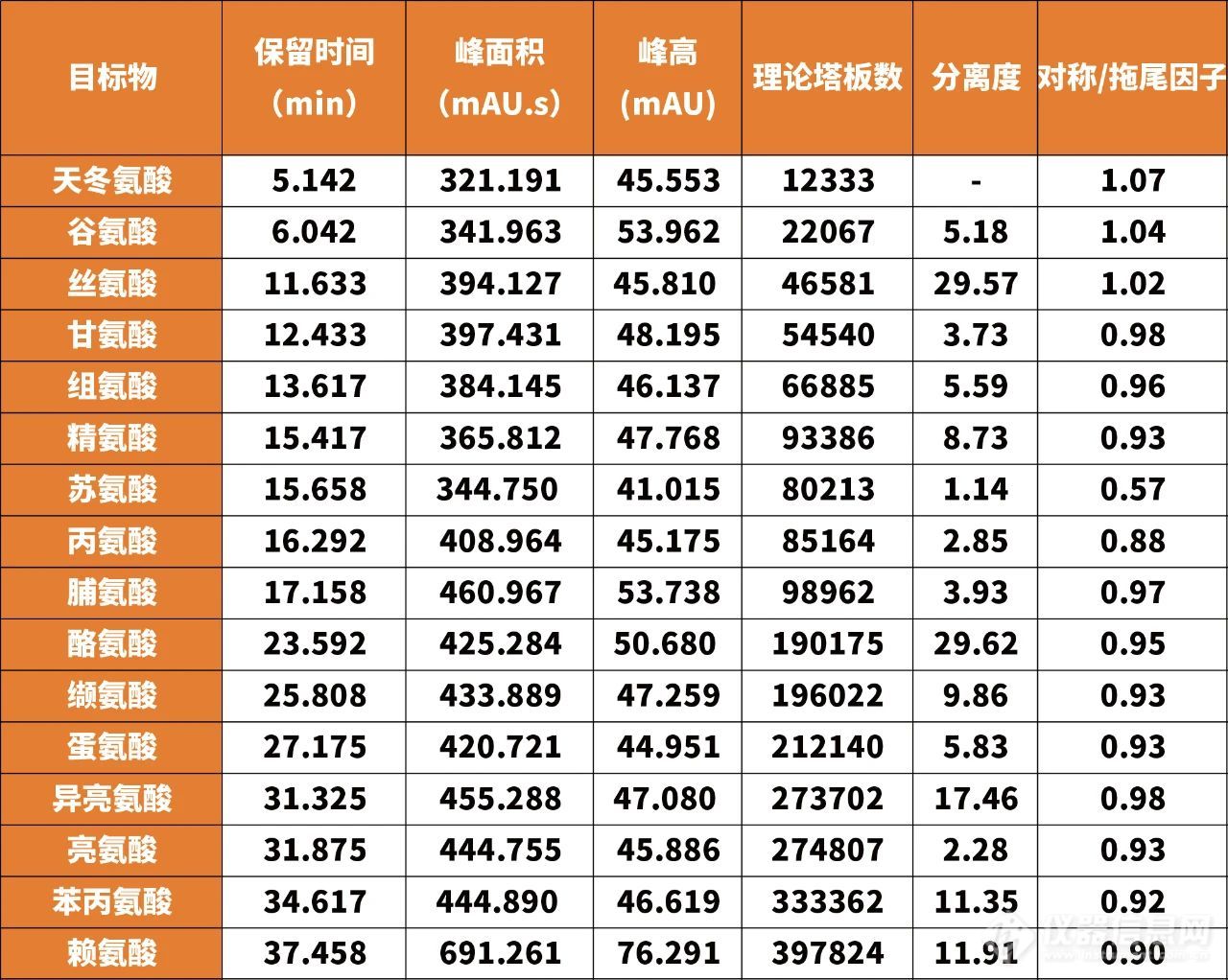
由表1中数据可知,16种氨基酸峰的理论塔板数范围为12333~397824,分离度范围为1.14~29.62,均可实现较好分离。
按照色谱条件进行采集,将16种氨基酸混合标准溶液上机测定,16种氨基酸在0.0625 μmol/mL~1.25 μmol/mL浓度范围内呈现良好的线性关系,确定系数R2的范围为0.9976 ~0.9999 。16种氨基酸混合标准溶液叠加的色谱图如图2所示。
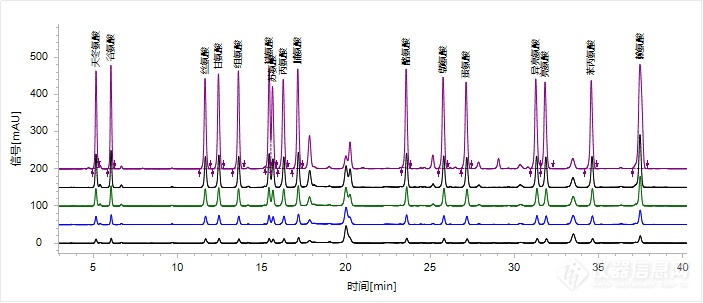
图2 16种氨基酸混合标准溶液叠加色谱图
3. 结论
本实验采用PITC柱前衍生-高效液相色谱法成功实现了重组胶原蛋白中16种氨基酸的检测。
胶原蛋白含量的检测方法多样,具体选择取决于样本类型、设备条件等,可根据实验室条件和需求选择合适方法,必要时可结合多种技术验证结果。



